Progrès thérapeutique 2013 : les thérapies ciblées anticancéreuses toujours en « pole position »
 Selon le bilan du progrès thérapeutique 2013 présenté mercredi par le Leem, une série d’autorisations a confirmé la place croissante des thérapies ciblées dans l’arsenal thérapeutique : 12 thérapies ciblées anticancéreuses pour l’EMA, 9 pour la FDA. Le bilan 2013 compte une quinzaine de médicaments biologiques, (15 pour l’Europe, 14 pour les Etats-Unis) et 5 médicaments orphelins autorisés par l’EMA (1 seulement pour la FDA ).
Selon le bilan du progrès thérapeutique 2013 présenté mercredi par le Leem, une série d’autorisations a confirmé la place croissante des thérapies ciblées dans l’arsenal thérapeutique : 12 thérapies ciblées anticancéreuses pour l’EMA, 9 pour la FDA. Le bilan 2013 compte une quinzaine de médicaments biologiques, (15 pour l’Europe, 14 pour les Etats-Unis) et 5 médicaments orphelins autorisés par l’EMA (1 seulement pour la FDA ).
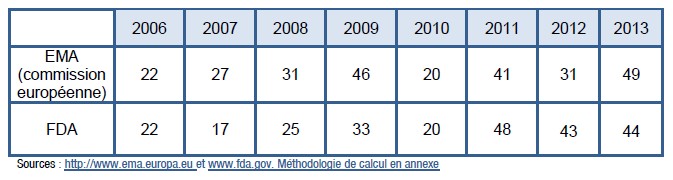
En 2013, 49 nouveaux médicaments ou associations de médicaments ont été autorisés par la Commission européenne. « Un chiffre qui démontre le dynamisme de la recherche pharmaceutique », estime le Leem. En 2013, les nouveaux médicaments se concentrent sur 11 aires thérapeutiques, contre 18 en 2012. Même tendance outre-Atlantique, le flux d’innovations ne se tarit pas avec 44 nouveaux médicaments autorisés.
Ces chiffres sont construits sur le périmètre de l’EMA incluant donc aussi les vaccins et les produits dérivés du sang. Au total, en 2013, 12 nouvelles molécules ou associations de molécules ont été enregistrées à la fois à la FDA et en Europe.
En ligne avec les précédents bilans du progrès thérapeutique, les anticancéreux occupent toujours la première place avec 16 médicaments en Europe et 11 médicaments aux Etats-Unis, représentant la majorité des médicaments autorisés (entre le tiers en Europe et le quart aux Etats-Unis). L’infectiologie, avec 8 médicaments en Europe (dont 3 médicaments contre le VIH et 4 vaccins) et 7 aux Etats-Unis ainsi que les maladies du métabolisme, avec 7 médicaments contre le diabète en Europe et 4 aux Etats-Unis, arrivent respectivement en deuxième et troisième position, confirmant la vitalité de la recherche dans ces deux domaines thérapeutiques.
Les thérapies ciblées en « pole position »
Les thérapies ciblées dans le domaine du cancer, c’est-à-dire des thérapies « sélectives » s’attaquant aux cellules cancéreuses, tiennent la » pole position », représentant à elles-seules 80 % des produits anticancéreux autorisés en 2013 en Europe et aux Etats-Unis. Ce sont pour une large part des inhibiteurs de tyrosine kinase qui bloquent les signaux conduisant à la croissance des cellules cancéreuses. Ont aussi été autorisés un inhibiteur d’une autre voie de signalisation spécifique (la voie « hedgehog ») ainsi qu’un anticorps monoclonal ciblant spécifiquement la protéine HER2.
L’innovation est donc largement le fait du ciblage de mécanismes spécifiques de la maladie, que ce soit en bloquant les voies de signalisation des cellules ou en s’attaquant à des récepteurs de protéines spécifiques, afin « d’affamer les cellules cancéreuses » et les empêcher ainsi de se multiplier.
Les « premières » du bilan 2013
Dans le domaine du cancer, l’année 2013 a été marquée aux Etats-Unis par l’autorisation concomitante de thérapies ciblées et de leurs diagnostics compagnons associés. Il s’agit de l’afatinib (Gilotrif® (USA)/Giotrif® (EU) pour lequel la FDA a autorisé simultanément la mise sur le marché du test correspondant, le test therascreen EGFR/RGQ/PCR Kit. Le dabrafenib et le trametinib ont également été autorisés en même temps que leur test compagnon associé, le THxID™-BRAF.
L’Agence européenne du médicament a autorisé deux nouveaux produits de thérapies avancées. Il s’agit d’un nouveau produit d’ingénierie tissulaire, MACI® pour la réparation des lésions cartilagineuses aux extrémités des os de l’articulation du genou, et de Provenge® un vaccin thérapeutique.
La FDA a autorisé le premier médicament antisens2, le mipomersen (Kynamro®) pour le traitement de l’hypercholestérolémie familiale. Enfin, le premier représentant d’une nouvelle classe d’antiviraux, les inhibiteurs de la protéine NS5b du virus de l’hépatite C, a été autorisé par la FDA en 2013. Il s’agit du sofosbuvir (Sovaldi®) qui a obtenu le statut de « breakthrough therapy » de la FDA en 2013. Le statut de breakthrough therapy a été mis en place en juillet 2012. Il ouvre la possibilité d’un accompagnement de l’industriel par l’agence sur la conduite du développement en plus d’une évaluation accélérée. Ce statut est accordé à des traitements de maladies graves ou mortelles qui ont montré des premières données cliniques prometteuses.
Source : Leem

