Progrès thérapeutique 2011: la France en décalage avec les évaluations internationales selon le Leem
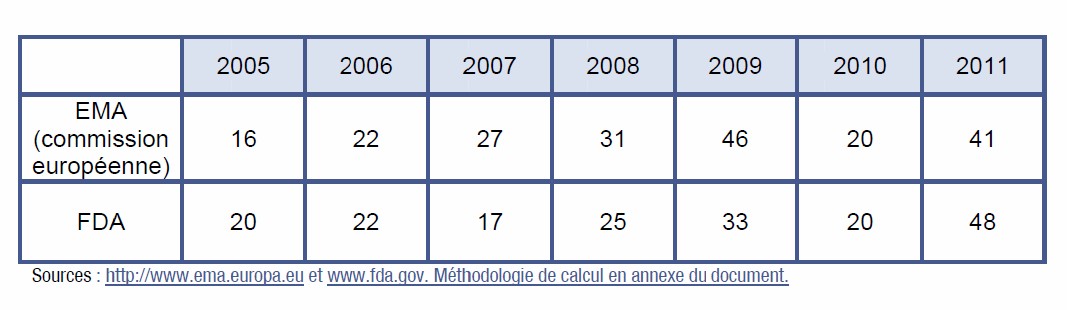
 48 nouveaux médicaments ou associations de médicaments ont été autorisés en 2011 par la Food and Drug Administration (FDA) et 41 par l’Agence Européenne du Médicament (EMA), contre 20 en 2010 par chaque agence. « Ce chiffre est l’un des plus élevés de la dernière décennie », a constaté la FDA, lors de son bilan, publié le 3 novembre 2011. La plupart des autorisations concernent des thérapies ciblées qui s’affirment comme une tendance lourde de l’innovation thérapeutique du 21ème siècle.
48 nouveaux médicaments ou associations de médicaments ont été autorisés en 2011 par la Food and Drug Administration (FDA) et 41 par l’Agence Européenne du Médicament (EMA), contre 20 en 2010 par chaque agence. « Ce chiffre est l’un des plus élevés de la dernière décennie », a constaté la FDA, lors de son bilan, publié le 3 novembre 2011. La plupart des autorisations concernent des thérapies ciblées qui s’affirment comme une tendance lourde de l’innovation thérapeutique du 21ème siècle.
La plupart des nouveaux médicaments de 2011 représentent d’importantes avancées dans la prise en charge de maladies qui ne disposaient pas de traitements suffisamment efficaces comme le mélanome métastatique, l’hépatite C, le lupus (premier nouveau médicament en 50 ans), la maladie de Hodgkin (premier nouveau médicament en 30 ans) ou le cancer de la prostate.
Les progrès sont particulièrement sensibles dans le champ du mélanome métastatique où les malades disposent désormais de deux nouvelles thérapies ciblées, un inhibiteur enzymatique ciblant la mutation de la protéine BRAF et une immunothérapie ciblant un récepteur spécifique des lymphocytes T, leur permettant d’augmenter significativement leurs chances de survie.
L’autre progrès majeur de 2011 concerne l’hépatite C : les malades résistants aux bithérapies interféron et antiviral peuvent désormais bénéficier de trithérapies, associant de nouvelles molécules – les anti protéases – aux deux molécules déjà prescrites, qui permettent de guérir 75% des patients en échec thérapeutique.
Au vu de ces données internationales, les Entreprises du Médicament (Leem) déplorent que les évaluations des autorités françaises continuent de se détériorer. En effet, l’évaluation française de la Commission de Transparence de la Haute Autorité de santé (HAS) s’inscrit en décalage avec les évaluations américaines et européennes, puisqu’elle n’a accordé en 2011 que 23 ASMR , dont 1 seule ASMR 1, 5 ASMR 3 et 17 ASMR 4.
Autre sujet de préoccupation : la France est de moins en moins choisie dans les évaluations permettant l’accès au marché :
– par l’Agence européenne (EMA) comme rapporteur ou co-rapporteur dans les procédures centralisées (évaluation européenne unique pour les produits très innovants)
– par les industriels, comme pays de référence dans les procédures décentralisées (process d’évaluation coordonné entre les pays européens) avec 7% des dossiers d’AMM européennes revenant à la France en 2010 contre 14% en 2009.
Dans son communiqué, le Leem attire ainsi » l’attention sur l’indispensable remise à niveau des standards internationaux de l’évaluation française afin de restaurer la lisibilité et la prédictibilité de la politique du médicament dans notre pays ».
Source : Leem
